
Reglas PARA Determinar EL Número DE Oxidación REGLAS PARA DETERMINAR EL NÚMERO DE OXIDACIÓN 1
Clorato. El número de oxidación de O en ClO3 {-} es -2 . El número de oxidación de Cl en ClO3 {-} es +5 . Elemento. Número de oxidación (promedio) Átomos. Count. Electronegatividad. O.

Numero de oxidacion del Cloro (Cl) en ion Perclorato ClO4 AULAEXPRESS YouTube
Puntualicemos: El hidrógeno (H) presenta número de oxidación +1 con los no metales y - 1 con los metales. El oxígeno (O) presenta el número de oxidación - 2 , excepto en los peróxidos donde es - 1. Los metales alcalinos (grupo 1, o grupo del Li) tienen 1 electrón de valencia, tenderán a perderlo poseyendo siempre en los compuestos número de oxidación +1 .

Numero De Oxidacion De Mgcl2 Balan
El número de oxidación de un elemento libre es cero, por ejemplo, Al (s) o Zn (s), O 2, N 2, F 2, Cl 2, Br 2. Esto también es válido para el azufre que se encuentra como S 8. El número de oxidación de un ion monoatómico es igual a la carga del ion, por ejemplo, Na+ = +1; S 2- = -2. La suma de los números de oxidación en un compuesto.

¿Qué es el número de Oxidación? YouTube
El estado de oxidación de un átomo en cualquier elemento puro, ya sea monatómico, diatómico o poliatómico, es cero. El estado de oxidación de un ion monoatómico es el mismo que su carga, por ejemplo, Na + = +1, Cl − = −1. El estado de oxidación del flúor en los compuestos químicos es siempre −1.

Asignación del número de oxidación de un elemento en un compuesto YouTube
Para el ion de cobre(II) en [CuCl 4] 2-, el número de coordinación es cuatro, mientras que para el ion de cobalto(II) en [Co(H 2 O) 6] 2+, el número de coordinación es seis. Cada uno de estos ligandos es monodentado, del griego "un diente", lo que significa que se conectan con el metal central a través de un solo átomo. En este caso, el.

Calculadora De Numeros De Oxidacion Compuestos Quimicos Redox Images
Ejemplo 1: El ion poliatómico sulfato tiene 1 átomo de azufre y 4 átomos de oxígeno, con una carga total de -2. Según la Regla 5, el oxígeno tiene un número de oxidación de -2 en este compuesto. Tenemos 4 átomos de oxígeno, cada uno con un número de oxidación de -2, por lo que la carga total del oxígeno es -8.

Numeros De Oxidacion Ejercicios abstractor
Y, por último, pero no menos importante, si observamos estos aniones hidróxido, cada uno de los oxígenos tendrá un número de oxidación de 2 negativo y el hidrógeno va a tener un 1 positivo, y podemos confirmar que eso tiene sentido: los 2 negativos más 1 darán 1 negativo para cada uno de estos iones. Así que ahora pensemos quién se.
Elementos Quimicos y su Transformacion Elementos Quimicos y su Clasificacion
Una reacción de oxidación-reducción, o reacción redox, es una reacción en la que hay una transferencia de electrones entre especies químicas (los átomos, los iones o las moléculas que intervienen en la reacción).Todo el tiempo se producen reacciones redox a nuestro alrededor: en la quema de combustibles, la corrosión de metales e incluso en los procesos de fotosíntesis y.

Que Es El Numero De Oxidacion Ejemplos Compartir Ejemplos Images and Photos finder
El cloro es un elemento químico con número atómico 17, lo que significa que hay 17 protones en su núcleo. Número total de protones en el núcleo se llama el número atómico del átomo y se le da el símbolo Z . La carga eléctrica total del núcleo es, por tanto, + Ze, donde e (carga elemental) es igual a 1,602 x 10-19 culombios .
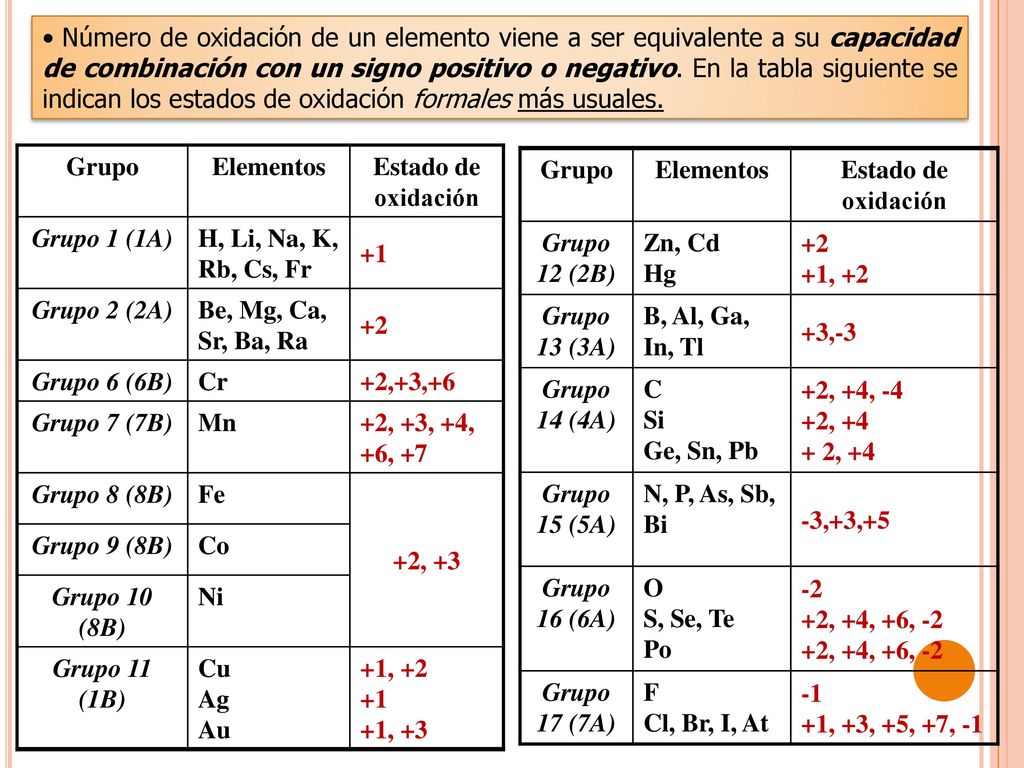
CIENCIA EN LA WEB Números de oxidación de los elementos químicos
Los números de oxidación de los metales alcalinotérreos (grupo 2) es +2. El número de oxidación del oxígeno en la mayoría de los compuestos es -2, exceptuando cuando forma peróxidos (H 2 O 2) que es -1 y cuando reacciona con el flúor (OF 2), donde el número de oxidación es +2. El hidrógeno en sus compuestos tienen número de.

Número de oxidación Aprende a calcularlo El Gen Curioso
De manera similar, el cloro puede tener números de oxidación que van desde −1 − 1 hasta +7 + 7. Figura 11.1.1 11.1. 1: El tiosulfato de sodio es un compuesto cristalino blanco (izquierda) compuesto por dos iones de sodio (Na+) ( Na +) por cada ion tiosulfato (S2O2−3) ( S 2 O 3 2 −) (derecha). Consideremos ahora el compuesto iónico.

Números de oxidación (estados de oxidación) YouTube
El número de oxidación, también llamado estado de oxidación, es aquel que describe la ganancia o pérdida de electrones en un átomo, asumiendo que el compuesto del que forma parte tiene un carácter puramente iónico.Por lo tanto, cuando se habla de número de oxidación, se da por sentado que todos los átomos se encuentran como iones interaccionando electrostáticamente.

Calculo de Número de Oxidación de un Compuesto. FÁCIL. YouTube
Para balancear una ecuación redox usando el método de semirreaciones, primero se divide la ecuación en dos medias reacciones, una que representa la oxidación, y otra que representa la reducción.Las ecuaciones de las semirreacciones entonces se balancean en cuanto a la masa y la carga y, si es necesario, se ajustan para que el número de electrones transferido en cada ecuación sea el mismo.

⚠️Número de oxidación Estados de oxidación EJERCICIOS⚠️ [Fácil y Rápido] QUÍMICA YouTube
Podemos considerar que el número de oxidación es lo que sería la carga del elemento si los electrones en el enlace covalente se transfirieran completamente al átomo más electronegativo.. Recuerda que el potasio es un elemento del grupo 1 que forma un ion 1+. El cloruro, por definición, es un anión que se ha formado de un átomo de.

¿Cómo asignamos el número de oxidación de elementos no metálicos representativos? Nueva
El número de oxidación de un elemento en su estado libre es cero, 0. Por ejemplo: H 2, O 2, P 4, etc. = 0. El número de oxidación de iónes monoatómicos es igual a la carga de dichos iones. Por ejemplo: Na + = +1, Ca 2+ = +2; Cl - = -1. El número de oxidación del hidrógeno es +1 en todos sus compuestos, excepto en los hidruros.

Como calcular el número de oxidación de iones poliatómicos. YouTube
Transcripción. Al balancear ecuaciones de reacciones redox que se producen en soluciones ácidas, se suele necesitar agregar iones de H⁺ o el par H⁺/H₂O para balancear la ecuación por completo. En este video analizaremos este proceso para la reacción entre iones de dicromato (Cr₂O₇²⁻) e iones de cloruro (Cl⁻) en una solución.
- Autobuses De Guadalajara A San Miguel Allende
- Qué Es La Danza Ritual
- Horario En Estambul Y Mexico
- Valores Normales De Los Signos Vitales
- Características De Un Texto Académico
- San Miguel Y San Gabriel
- World Naked Bike Ride Mexico
- Distancia De Matamoros A Monterrey
- Facil Dibujos De La Prehistoria
- Es Asi Mi Amor Diego Verdaguer Letra