
ProfeQuíMICA Azufre (S) Enseñanza de química, Tabla periodica de los elementos quimicos
Propiedades físicas del azufre. El azufre tiene un peso atómico de 32.066 gramos por mol y forma parte del grupo 16, la familia del oxígeno. Es un no metálico y tiene un calor específico de 0.706 J g -1 o C -1. La afinidad electrónica si es 200 kJ mol -1 y la electronegatividad es de 2.58 (sin unidades).
Azufre En La Tabla Periódica De Los Elementos Con El Símbolo De Elemento S Ilustración del
El azufre es un elemento químico con número atómico 16, lo que significa que hay 16 protones en su núcleo. Número total de protones en el núcleo se llama el número atómico del átomo y se le da el símbolo Z . La carga eléctrica total del núcleo es, por tanto, + Ze, donde e (carga elemental) es igual a 1,602 x 10-19 culombios .

Ciencias de Joseleg Propiedades periódicas del azufre
¿Sabes cómo contar los electrones de valencia para los elementos de los grupos principales de la tabla periódica? En este video, aprenderás a usar la configuración electrónica y el número de grupo para determinar el número de electrones de valencia de un átomo. Este concepto es muy importante para entender la reactividad y el enlace químico de los elementos. Si quieres profundizar.

El azufre Tabla Periódica de los elementos ilustración vectorial EPS 10 Imagen Vector de stock
Por lo tanto, los electrones de valencia del azufre son seis. La valencia es una característica numérica de la capacidad de los átomos de un elemento dado para unirse con otros átomos. La valencia del hidrógeno es constante e igual a uno. La valencia del oxígeno también es constante e igual a dos.

El estado de oxidación de azufre en H2SO4 es YouTube
El azufre es un elemento químico de número atómico 16, lo que significa que cada átomo de hierro cuenta con 16 protones en su núcleo atómico. Se representa con el símbolo S y se encuentra en el grupo 16 y el periodo 3 de la tabla periódica, por lo que pertenece al grupo de los no metales. En la Tierra, a temperatura y presión estándar.

CONFIGURACIÓN ELECTRÓNICA DEL AZUFRE Y ESTRONCIO YouTube
El azufre es un elemento químico de número atómico 16 y símbolo S (del latín sulphur).Es un no metal abundante con un color amarillo característico. [1] Dicho elemento es generado en estrellas masivas en las que predominan temperaturas que provocan la fusión entre un núcleo de silicio y otro de helio en un proceso denominado nucleosíntesis de supernovas.

Azufre Tabla periódica y propiedades atómicas
Azufre - Propiedades, historia, origen del nombre, hechos, aplicaciones, isótopos, configuración electrónica, estructura cristalina, peligros y más; Tabla periódica interactiva de los elementos químicos.. Número atómico. 16. Masa atómica. 32,065. Número Másico. 32. Categoría. No metales. Color.. El azufre se usa en multitud de.
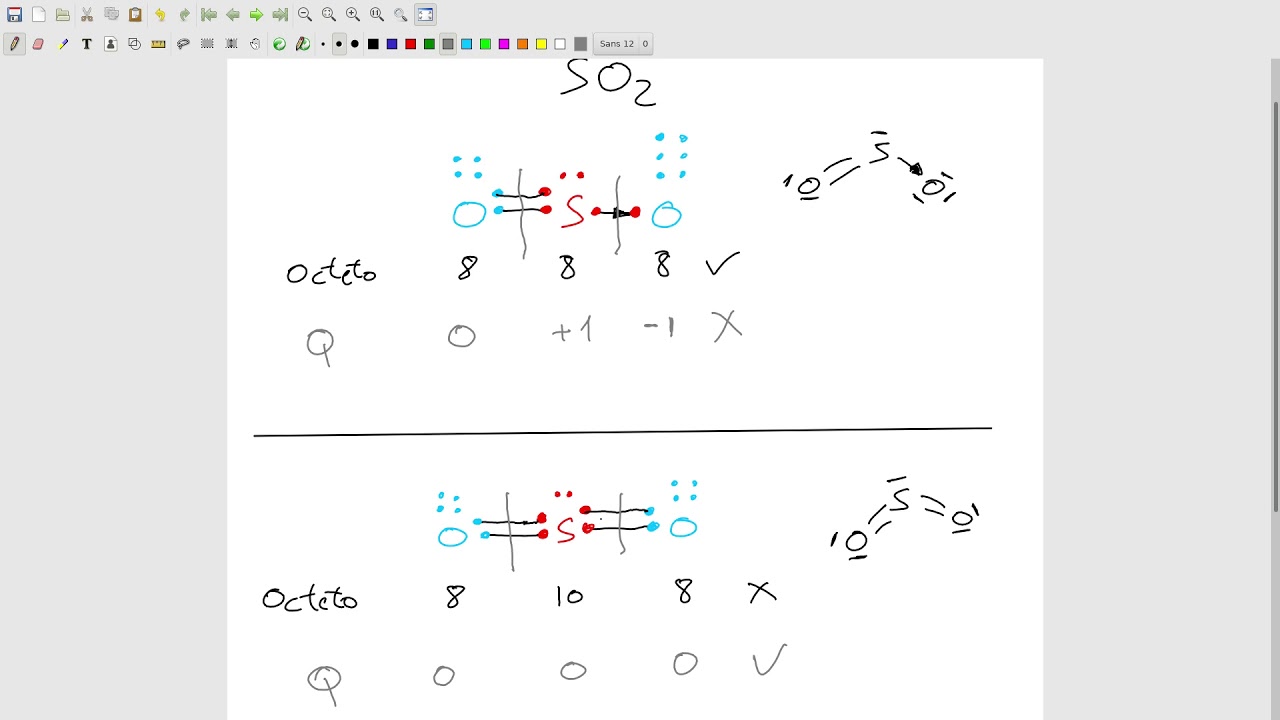
Diagrama de Lewis del dióxido de azufre, SO2, revisitada YouTube
Los electrones de valencia del azufre son aquellos que se encuentran en la capa más externa del átomo y son los responsables de establecer enlaces químicos con otros elementos. En el caso del azufre, este cuenta con seis electrones de valencia, los cuales pueden ser compartidos con otros átomos para formar compuestos.

Símbolo de azufre. Elemento químico de la tabla periódica. Ilustración de stock vectorial Imagen
Características del Azufre. Este elemento químico tiene una masa atómica de 32,064, está ubicado en el grupo 16 de la s tabla periódica. Es un elemento activo que se mezcla con otros compuestos fácilmente. Existe en estados de oxidación positivos y negativos y es multivalente en la formación de mezclas iónicas.

Diagrama De Punto De Lewis Azufre
Electrones de valencia y compuestos iónicos. Al formar iones, los elementos normalmente ganan o pierden el número mínimo de electrones necesario para lograr un octeto completo. Por ejemplo, el flúor tiene siete electrones de valencia, por lo que es más probable que gane un electrón para formar un ion con carga 1-.

Números cuánticos azufre, Ejercicio 10 YouTube
Química General → Tabla de Valencias. Tabla de Valencias: A continuación se muestran los números de valencia de los diferentes elementos químicos. IA. IIA. IIIB. IVB. VB. VIB.

Óxidos del Azufre fórmulas, nombres y ecuaciones químicas
El azufre tiene 6 electrones de valencia. Esto se debe a que se encuentra en el grupo 16 de la tabla periódica, lo que significa que tiene 6 electrones en su capa externa o de valencia. Los electrones de valencia son los electrones que se encuentran en la capa más externa del átomo y son los responsables de la formación de enlaces químicos.

Elemento químico de azufre, signo con número atómico y peso atómico, elemento de la tabla
La valencia es el número de conexiones que tiende a formar un átomo. H se define para tener una valencia de 1. Por ejemplo: metano, CH 4: los átomos de carbono tienen una valencia de 4. agua, H 2 O: el oxígeno tiene una valencia de 2. óxido de litio, Li 2 O: el litio tiene una valencia de 1. sulfuro de hidrógeno, H 2 S: el azufre tiene.
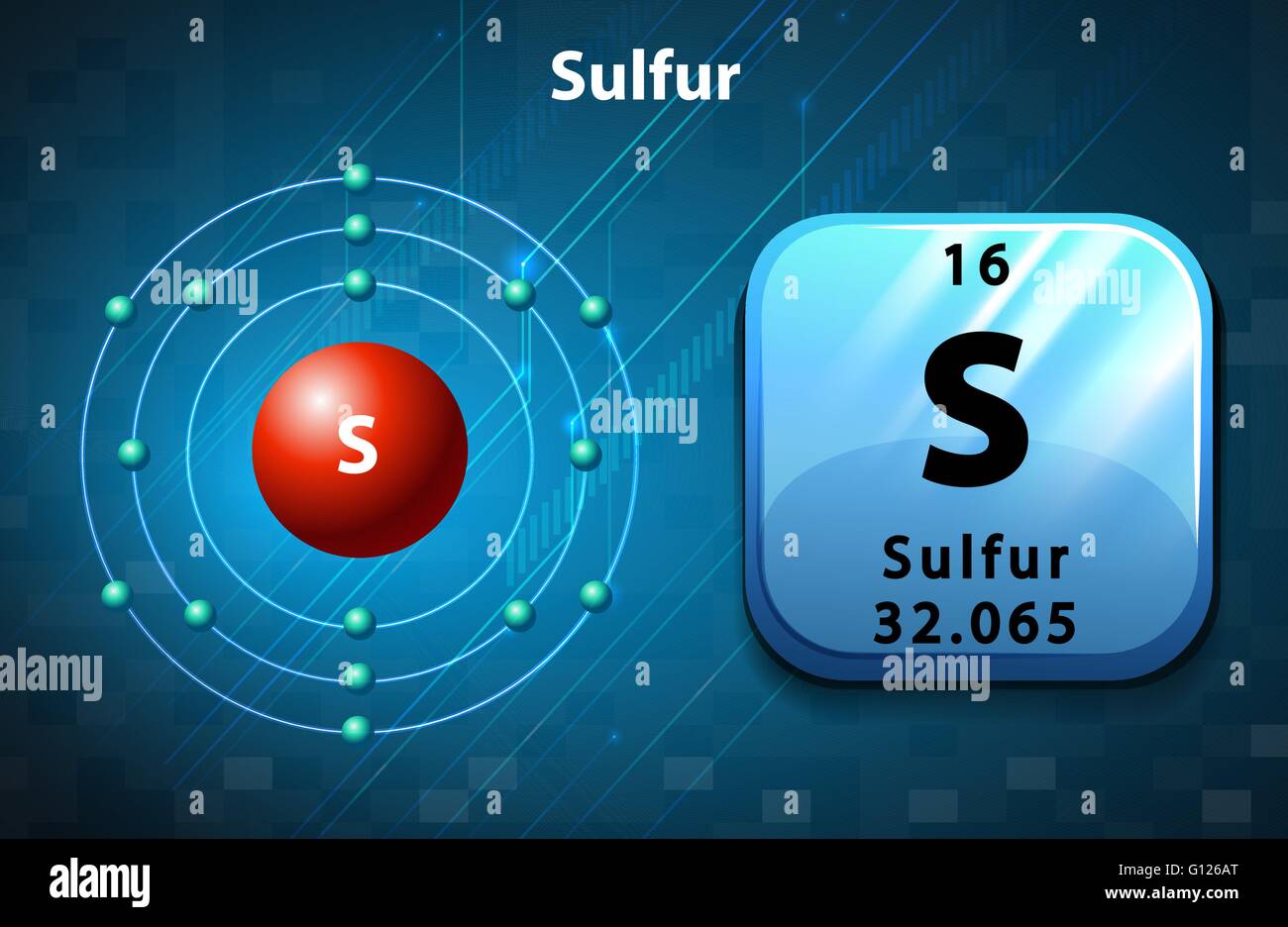
Azufre atomo fotografías e imágenes de alta resolución Alamy
Los electrones de valencia aumentan en número a medida que se avanza en un período. Luego, al comenzar el nuevo período, el número disminuye a uno y comienza a aumentar de nuevo. Por ejemplo, cuando en la tabla periódica se pasa del carbono al nitrógeno, y luego hacia el oxígeno, el número de electrones de valencia aumenta de 4 a 5 y.

Z=16 AZUFRE CONFIGURACIÓN ELECTRÓNICA Y DIAGRAMA DE ORBITALES CLASE 16 YouTube
Protones y neutrones en Azufre. El azufre es un elemento químico con número atómico 16, lo que significa que hay 16 protones en su núcleo. Número total de protones en el núcleo se llama el número atómico del átomo y se le da el símbolo Z . . La carga eléctrica total del núcleo es, por tanto, + Ze, donde e (carga elemental) es igual a 1,602 x 10-19 culombios .

cual es el numero ayomico del azufre Brainly.lat
La disposición de los electrones en los orbitales de un átomo se llama la configuración electrónica del átomo. Describimos una configuración electrónica con un símbolo que contiene tres datos (Figura 6.4.2 6.4. 2 ): El número de la capa cuántica principal, n, La letra que designa el tipo de órbita (la subcapa, l ), y.
- Toallas Saba Hello Kitty Precio
- Que Dice La Biblia Del Anticristo
- Punk Girl Hairstyles Long Hair
- Codigo Postal San Francisco De Asis
- Cual Es El Campo De Estudio De La Economia
- Que Es La Cancelacion De Ruido
- Donde Estan Las Rubias 2
- Que Son Los Derechos Morales
- Juegos Con Aros En Educacion Fisica
- Cuantos Dias Trae Una Semana