
QUÍMICA PREMEDICO CARORA electronegatividad de los elementos
La tabla de electronegatividad de los elementos es una herramienta fundamental para entender la química e interacciones entre los elementos que conforman la materia. A través de ella, podemos conocer el grado de atracción que tiene cada elemento por los electrones que rodean su núcleo y, de esta forma, entender cómo se relacionan entre sí.
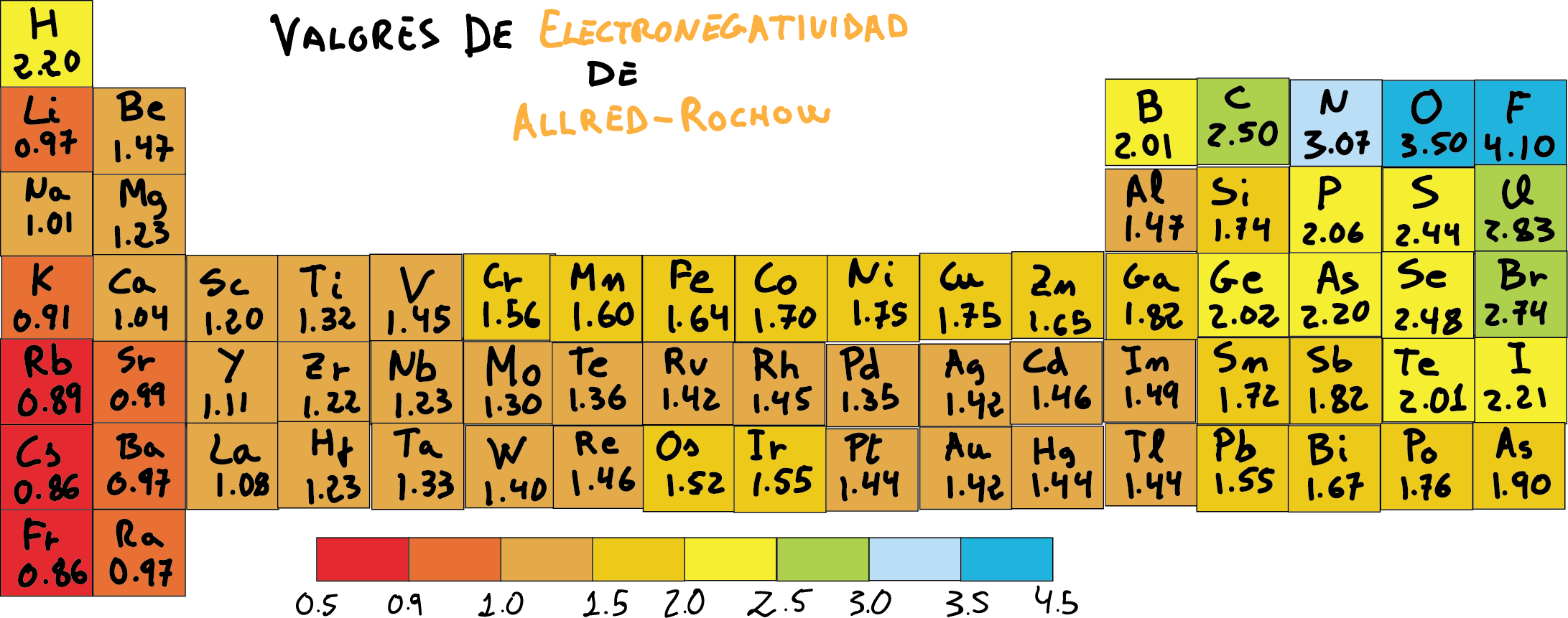
Linus Pauling Tabla De Electronegatividad wenda
La tabla de electronegatividad es una herramienta científica que clasifica la capacidad de los elementos para atraer electrones en una molécula. Esta tabla se basa en la escala de Pauling, que establece al flúor como el elemento más electronegativo con un índice de 4.0.. Además, la comparación de los valores de electronegatividad de.
:max_bytes(150000):strip_icc()/PeriodicTableEnegativity-56a12c955f9b58b7d0bcc69d.png)
Printable Periodic Table of the Elements Electronegativity
La electronegatividad es la fuerza, el poder de un átomo en una molécula de atraer a los electrones hacia sí mismo. [1] También debemos considerar la distribución de densidad electrónica alrededor de un átomo determinado frente a otros distintos, tanto en una especie molecular como en sistemas o especies no moleculares.. La electronegatividad de un átomo determinado está afectada.

Tabla Periodica Electronegatividad Pdf
Tabla periódica moderna, con 18 columnas, que incluye los símbolos de los últimos cuatro nuevos elementos aprobados el 28 de noviembre de 2016 por la IUPAC: Nh, Mc, Ts y Og. [1] La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico (número de protones), [2] por su configuración de electrones y sus.
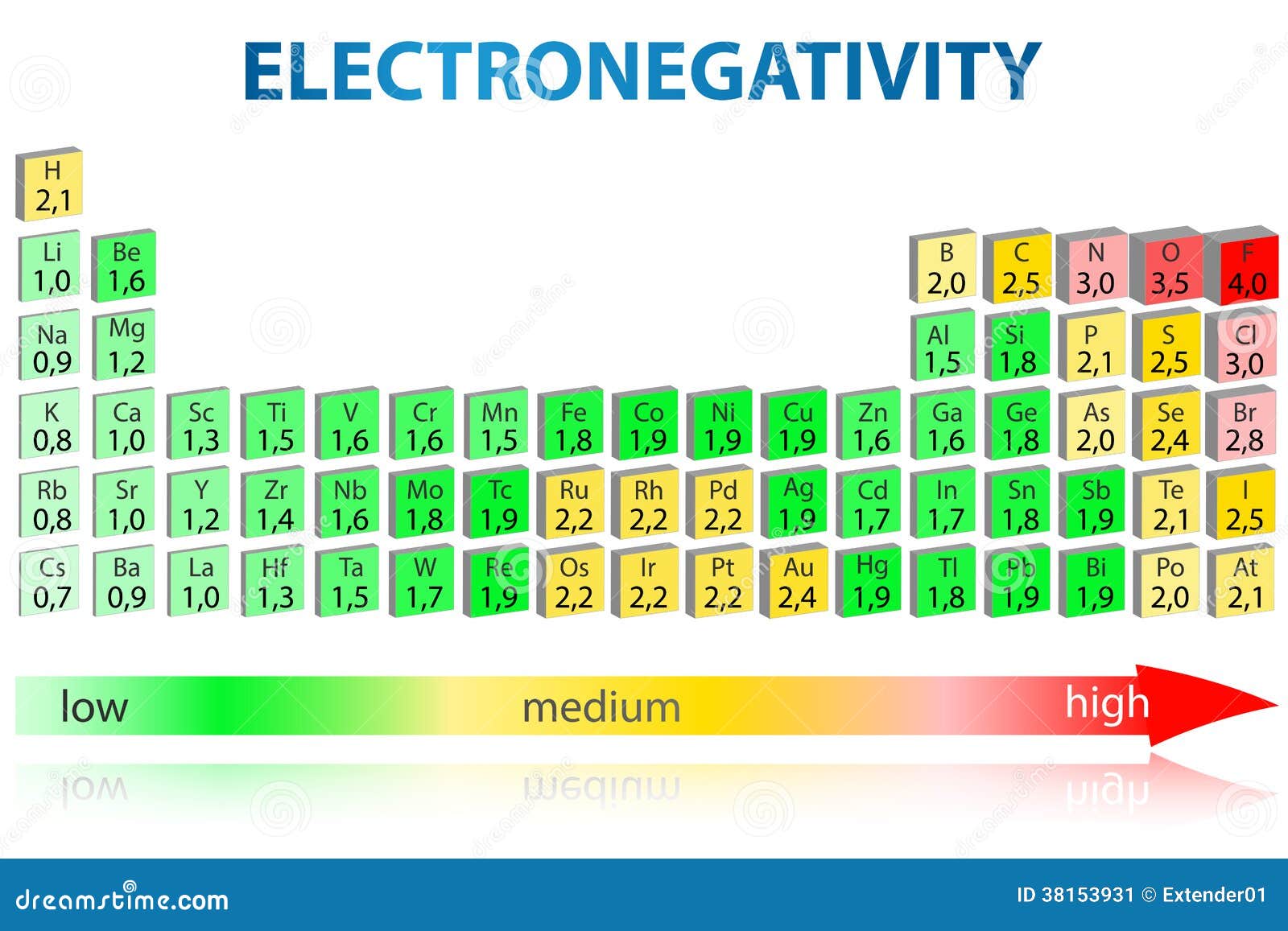
Tabla Periódica Del Electronegativity Imagen de archivo Imagen 38153931
Valores de Electronegatividad de Pauling en la Tabla Periódica. Dicho concepto aparece como uno de los descriptores químicos más antiguos para predecir la reactividad de las moléculas. Berzelius (1779-1848), basándose en los conceptos de electricidad de su época, intenta clasificar las sustancias en electropositivas y electronegativas.

Electronegatividad Química 1 CiberTareas
La electronegatividad de los elementos. Pauling, junto a Don M. Yost, halló los valores de electronegatividad de manera empírica, a través de datos experimentales que obtuvo midiendo las energías de enlace. Pauling asignó al elemento flúor -arriba y a la derecha de la tabla de la figura 1- la electronegatividad más alta, con el número 4.0.

Electronegatividad de Pauling ¡En 2 minutos! YouTube
La electronegatividad suele aumentar de izquierda a derecha a lo largo de un período (filas de la tabla periódica). La electronegatividad suele disminuir al moverse hacia abajo en un grupo (columnas de la tabla periódica). Los gases nobles suelen presentar electronegatividad nula. La mayor electronegatividad la tiene el flúor (3.98).

Electronegativity Definition and Trend
Tabla periódica | Lecciones de química | Ciencia | Khan Academy. 19 unidades · 53 habilidades. Unidad 1 Átomos, iones y compuestos. Unidad 2 Más acerca de los átomos. Unidad 3 Más acerca de la composición molecular. Unidad 4 Espectrometría de masas. Unidad 5 Reacciones químicas y estequiometría.

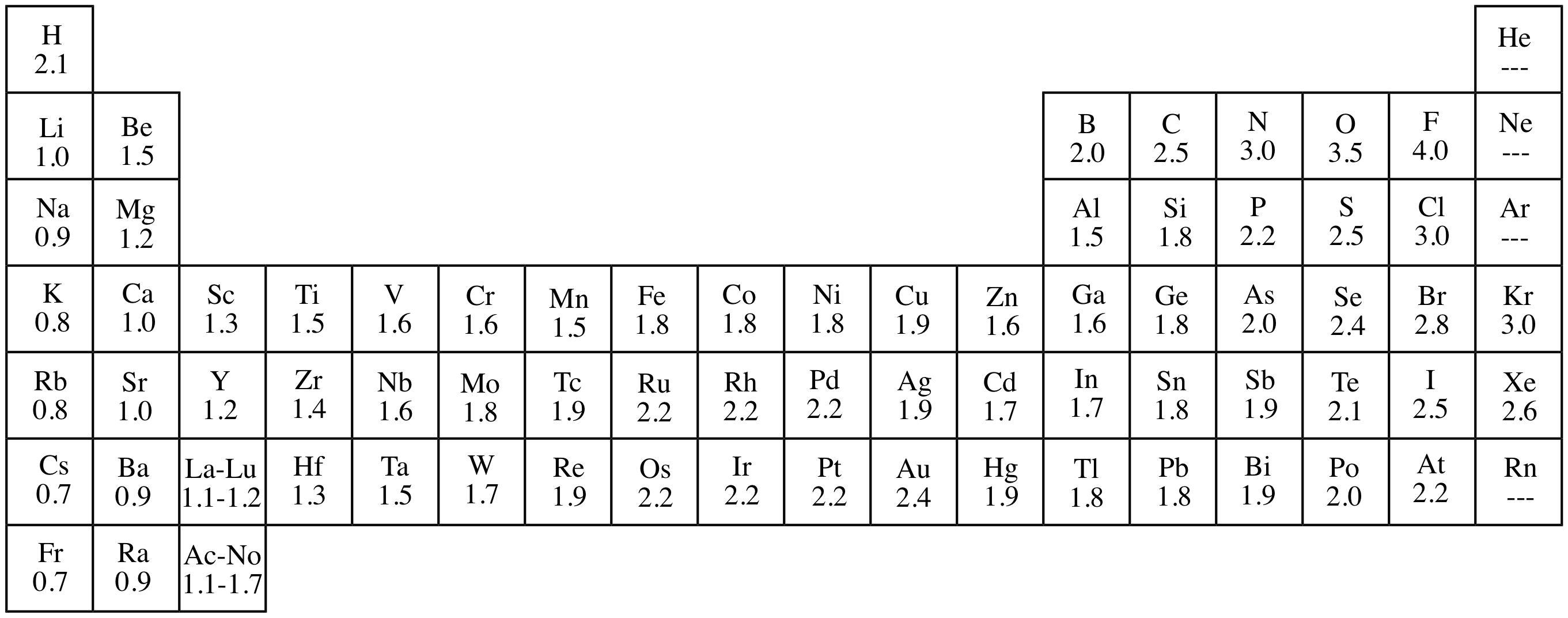
Tabla de Electronegatividad de Los Elementos PDF Física atómica Conjuntos de elementos
La electronegatividad de un elemento es definida como la capacidad relativa de un átomo para atraer electrones de otro átomo para enlazarse químicamente y formar un compuesto. La electronegatividad es una propiedad periódica. En la siguiente tabla observarás la variación de la electronegatividad, ésta va aumentando de izquierda a derecha.
.PNG)
Periodic Table of Electronegativities
La electronegatividad de los elementos se organiza del menos electronegativo al elemento más electronegativo en la tabla periódica, que sabemos que es la organización de los elementos químicos según su número de átomos, configuración electrónica y propiedades químicas clasificados en grupos y periodos, donde los grupos se reconocen en.

Electronegatividad qué es, propiedades e importancia (con tablas) Toda Materia
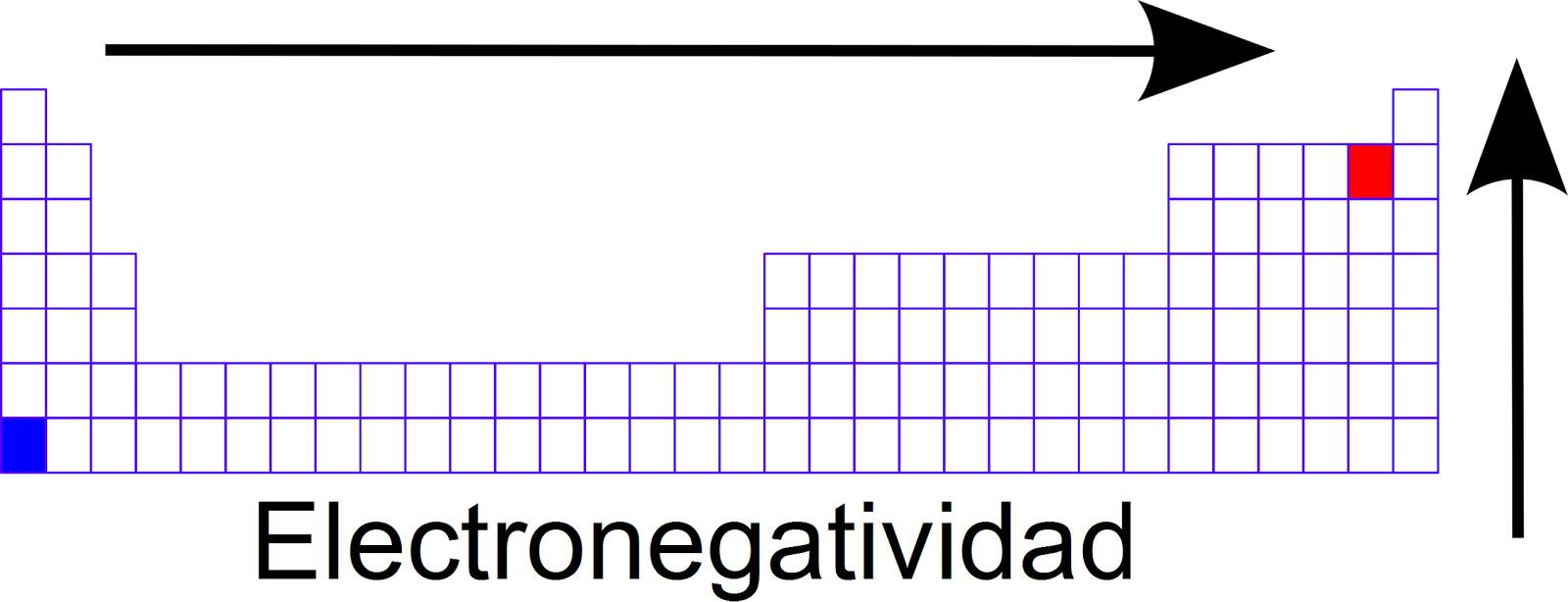
Electronegatividad. La electronegatividad es una medida de la capacidad de un átomo de atraer hacia sí mismo los electrones que comparte. En la tabla periódica, la electronegatividad generalmente aumenta a medida que te mueves de izquierda a derecha dentro de un periodo y disminuye conforme bajas dentro de un grupo.

Escala de electronegatividad de Pauling
Para utilizar la Tabla de Electronegatividad de Pauling, debes conocer las electronegatividades de los elementos involucrados en la molécula. Cuanto mayor sea la diferencia de electronegatividad entre dos átomos, más polar será el enlace entre ellos. Si la diferencia de electronegatividad es pequeña o nula, el enlace será no polar.
Illustrated Glossary of Organic Chemistry Electronegativity
La electronegatividad no se mide en unidades de energía, sino en una escala relativa. Todos los elementos se comparan entre sí, asignándose al elemento más electronegativo, el flúor, un valor de electronegatividad de 3.98. El flúor atrae los electrones mejor que cualquier otro elemento. En la siguiente tabla se muestran los valores de.
Quimica 2.2.6 Electronegatividad.
Comprensión de los Valores de Electronegatividad. Los valores de electronegatividad varían de 0 a 4, siendo 4 el valor más alto. En general, los elementos hacia el lado derecho de la tabla periodica electronegatividad tienden a tener valores de electronegatividad más altos. Los no metales, como el flúor y el oxígeno, exhiben alta.
.PNG)
Pauling scale of electronegativity;
El concepto de una escala de electronegatividad para los elementos fue propuesto por Pauling. La afinidad electrónica de un átomo proporciona una medida directa de la capacidad de un átomo para atraer y unir un electrón: X +e− → X− (7.5.1) (7.5.1) X + e − → X −. con ΔE = Ax Δ E = A x.

🔥Electronegatividad de Pauling y EJERCICIOS⚗️ [Fácil y Rápido] QUÍMICA YouTube
Se les llama electronegativos a los elementos de la tabla periódica (mas específicamente a los elementos que están mas hacia la derecha y hacia arriba en la tabla periódica, excepto el grupo 18 de los gases nobles) porque la propiedad que poseen es que estos tienden a atraer electrones de otros elementos para formar así la regla del octeto, un estado en el que los compuestos ionicos.
- Para Que Sirve El Compostador En Minecraft
- Jueces La Voz Senior España
- Eclipse Solar Y Lunar Diferencias
- Call Of Duty Battlefield 1
- Anillos De Matrimonio Y Compromiso En Oro
- Como Se Llama La Novia De El Conejo Bos Bony
- Horarios De La Liguilla Mx 2019
- Cuanto Tarda En Sanar Un Piercing En El Ombligo
- Domain 7e Eating Scale Questionnaire Pdf
- Imágenes De La Película La Bella Y La Bestia Animada